La tabla de valencias es una herramienta fundamental en la química, ya que nos permite comprender cómo los elementos se combinan para formar compuestos. En este artículo, exploraremos en detalle qué son las valencias y cómo se utilizan para determinar la fórmula química de un compuesto.
Las valencias representan la capacidad de un átomo para unirse con otros átomos y formar enlaces químicos. Cada elemento tiene una valencia específica, que puede ser positiva o negativa. Estas valencias se indican mediante números romanos o mediante la posición del elemento en la tabla periódica.

¿Qué son las valencias?
Las valencias son una propiedad de los elementos químicos que determina su capacidad para formar enlaces con otros elementos. Cada elemento tiene una valencia específica, que puede ser positiva o negativa. La valencia positiva indica que el elemento tiende a perder electrones para formar enlaces, mientras que la valencia negativa indica que el elemento tiende a ganar electrones.
Las valencias se utilizan para determinar la fórmula química de un compuesto. La fórmula química muestra la proporción en la que los elementos se combinan para formar el compuesto. Para determinar la fórmula química, es necesario conocer las valencias de los elementos involucrados y equilibrar las cargas positivas y negativas.
¿Cómo se utilizan las valencias para formar compuestos?
Las valencias se utilizan para determinar cómo los elementos se combinan para formar compuestos. Cuando un elemento tiene una valencia positiva, tiende a perder electrones y formar enlaces iónicos con elementos que tienen valencias negativas. Por ejemplo, el sodio (Na) tiene una valencia positiva de +1, mientras que el cloro (Cl) tiene una valencia negativa de -1. Estos dos elementos se combinan para formar el compuesto cloruro de sodio (NaCl).

¿Qué son las valencias de los elementos químicos?
Las valencias de los elementos químicos son la capacidad que tienen los átomos de un elemento para combinarse con otros átomos y formar compuestos. Estas valencias determinan la cantidad de electrones que un átomo puede ganar, perder o compartir durante una reacción química.
Las valencias se representan mediante números positivos o negativos que indican la cantidad de electrones que un átomo puede ganar o perder. Por ejemplo, un átomo con una valencia de +1 puede perder un electrón, mientras que un átomo con una valencia de -2 puede ganar dos electrones.
Es importante tener en cuenta que las valencias de los elementos químicos no son fijas y pueden variar dependiendo de las condiciones en las que se encuentren. Además, algunos elementos pueden tener múltiples valencias, lo que les permite formar diferentes tipos de compuestos.
Importancia de conocer las valencias en la formación de compuestos
Conocer las valencias de los elementos químicos es fundamental para comprender cómo se forman los compuestos químicos. La valencia de un elemento indica la capacidad que tiene para combinarse con otros elementos y formar enlaces químicos.
Al conocer las valencias de los elementos, podemos predecir qué tipo de compuestos se pueden formar y cómo se van a unir los átomos. Esto es especialmente útil en la química orgánica, donde se estudian los compuestos que contienen carbono.
Además, el conocimiento de las valencias nos permite entender las reacciones químicas y cómo se producen los cambios en las sustancias. Por ejemplo, si sabemos las valencias de los elementos que reaccionan, podemos predecir qué productos se formarán y cómo se distribuirán los átomos en las moléculas resultantes.
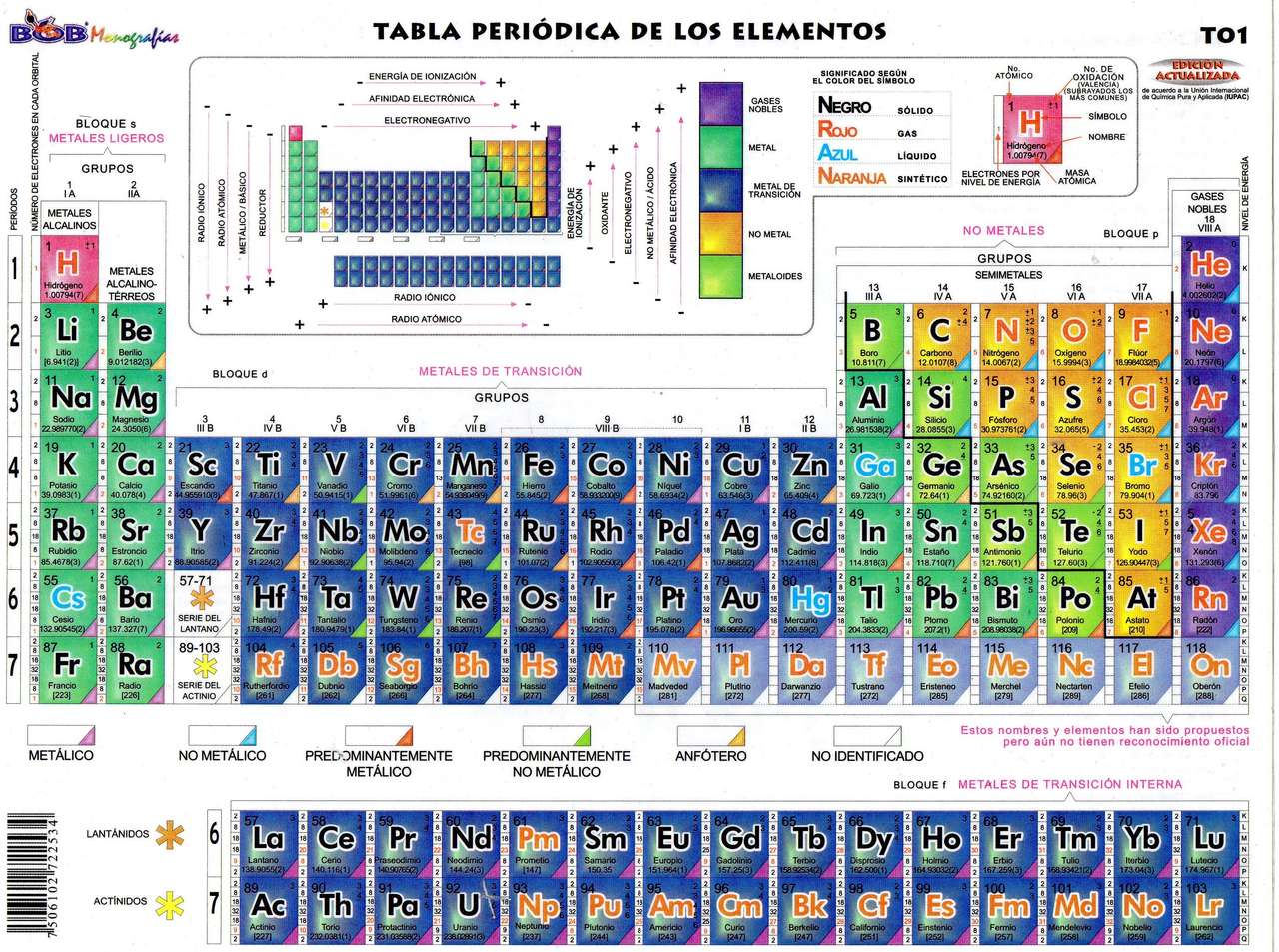
¿Cómo se representan las valencias en la tabla periódica?
Las valencias de los elementos químicos se representan en la tabla periódica a través de los números de oxidación. Estos números indican la capacidad de un átomo para ganar, perder o compartir electrones durante una reacción química. En la tabla periódica, los números de oxidación se encuentran en la parte superior de cada elemento, justo debajo del símbolo químico.
Las valencias pueden ser positivas o negativas, dependiendo de si el átomo tiende a perder o ganar electrones. Por ejemplo, los metales tienden a perder electrones y tienen valencias positivas, mientras que los no metales tienden a ganar electrones y tienen valencias negativas. Algunos elementos, como el hidrógeno y el oxígeno, pueden tener diferentes valencias dependiendo de los compuestos en los que se encuentren.
Es importante tener en cuenta que las valencias en la tabla periódica son una representación general y pueden variar en diferentes compuestos. Por ejemplo, el sodio tiene una valencia de +1, pero en el compuesto cloruro de sodio (NaCl), su valencia es de +1. Por otro lado, el cloro tiene una valencia de -1, pero en el compuesto cloruro de sodio, su valencia es de -1.
Elementos con valencia positiva
Los elementos con valencia positiva son aquellos que tienden a perder electrones durante una reacción química. Esto se debe a que su capa de valencia está incompleta y buscan estabilizarse al perder electrones y adquirir una configuración electrónica más estable.
Algunos ejemplos de elementos con valencia positiva son el sodio (Na), el potasio (K) y el calcio (Ca). Estos elementos tienen una sola carga positiva y tienden a formar compuestos iónicos al perder un electrón y adquirir una configuración electrónica similar a la de los gases nobles.
Por ejemplo, el sodio tiene una valencia de +1 y tiende a perder un electrón para adquirir una configuración electrónica similar a la del neón. Al perder este electrón, el sodio se convierte en un catión con una carga positiva de +1. Este catión de sodio puede combinarse con un anión de carga negativa para formar un compuesto iónico, como el cloruro de sodio (NaCl).

Elementos con valencia negativa
Existen ciertos elementos en la tabla periódica que tienen una tendencia a ganar electrones durante una reacción química, lo que resulta en una valencia negativa. Estos elementos son conocidos como elementos electronegativos. Algunos ejemplos de elementos con valencia negativa son el oxígeno, el flúor y el cloro.
El oxígeno, por ejemplo, tiene una valencia negativa de -2. Esto significa que durante una reacción química, el oxígeno tiende a ganar dos electrones para alcanzar la configuración electrónica estable. De manera similar, el flúor tiene una valencia negativa de -1, lo que indica que tiende a ganar un electrón. El cloro también tiene una valencia negativa de -1.
Estos elementos con valencia negativa son muy importantes en la formación de compuestos químicos. Al ganar electrones, pueden establecer enlaces químicos con elementos que tienen valencia positiva, como los metales. Esto permite la formación de compuestos estables y diversos en la naturaleza.
